
TISSUE LEVEL SLActive

שתלי ®TISSUE LEVEL SLActive הינם שתלים מיוחדים אשר מאפשרים תוצאות קליניות יוצאות דופן:
- SLActive מאפשר שיקום מהיר תוך 3-4 שבועות*
- SLActive מאפשר הצלחה במקרים מאתגרים ובמטופלים בקבוצות סיכון
- SLActive הינו השתל היחיד המאושר ע"י FDA למטופלים שעברו הקרנות
- SLActive הינו ההשתל היחיד המאושר ע"י FDA למטופלים סכרתיים
- שתל Tissue Level - מחקרים מראים ספיגה צווארית MBL של עד 0.95 מ"מ בטווח של 10 שנים!*
- במחקר הגדול ביותר שנעשה על שתלים דנטלים נמצא כי שתלי שטראומן Tissue Level הציגו את השרידות הטובה ביותר. בנוסף נמצאו הסיכויים הנמוכים ביותר לפריאימפלנטיטיס בטווח של 9 שנים (לשתלי נובל ביוקר ואסטרה פי 3.5 לעומת שטראומן)** לינק למאמר.
חומר הגלם: שתלי TISSUE LEVEL SLActive מיוצרים מ- ®Roxolid שהינו פטנט של שילוב מתכות יחודי : 85% טיטניום טהור דרגה 4 ו15% זירקוניום. ה-®Roxolid מעניק לשתל חוזק מירבי ויכולת ליצרו בקטרים צרים ואורכים קצרים.
טיפול פני שטח: טכנולוגית החספוס של פני שטח השתל הידועה בשם ®SLA הומצאה ע"י שטראומן עוד בשנת 1997 והיא מאפשרת לייצר חספוס אידאלי של 20-40 מיקרון (חיספוס מאקרו) ו2-4 מיקרון (חיספוס מיקרו). הגדלת פני השטח בעזרת החספוס היחודי של שטראומן מאפשר לאוסיובלאסטים להתחבר בצורה עדיפה לשתל ובכך משפרת את תהליך האוסטיואינטגרציה ומקצרת את זמן השיקום ל6-8 שבועות בלסת תחתונה ו10-12 שבועות בלסת עליונה.
®SLActive הינו פטנט יחודי של שטראומן שפותח בשנת 2005 ומשפר את טיפול פני השטח בכך שבתהליך של אקטיבציה כימית מסירים את הפחממנים שנמצאים באטמוספירה מפני שטח השתל. השתל נשמר בתוך פתרון נוזלי המונע התחברות מחודשת של הפחממנים לגוף השתל. עם החדרת השתל ללסת, הגוף מתחיל את תהליך האוסטיואינטגרציה מהשנייה הראשונה ובכך מאפשר לקצר את זמן קליטת השתל והשיקום ל3-4 שבועות בלסת תחתונה ו6-8 שבועות בלסת עליונה. בנוסף התהליך המיוחד הופך את השתל להידרופילי, מושך נוזלים (דם), ובכך מאפשר להגדיל את ה-BIC (מגע עצם לשתל) ב50%.
למחקרים ומידע נוסף
כידוע, לגוף האדם לוקח כ3-4 שבועות לפרק את הפחממנים שנמצאים על פני שטח השתל ורק לאחר סיום תהליך הפירוק מתחיל את תהליך האוסטיואינטגרציה. לכן זמן הריפוי של ®SLActive מאפשר לקצר את זמן קליטת השתל והשיקום ב3-4 שבועות מזמני השיקום המאפיינים את שתלי SLA של שטראומן. במידה ושתל ®SLActive הושתל בעצם רכה או עצם שעברה במקביל אוגמנטציה יש להמתין 4 שבועות נוספים. שתלי שטראומן שמיוצרים בטכנולוגית ®SLActive נמצאו כיעיל למטופלים מקבוצות סיכון כגון : מעשנים כבדים, סכרתיים, חולי אוסטאופרוזיס וחולים שעברו הקרנות.
יתרונות:
- השתל הינו הידרופילי
- מושך המון דם - האוסאואינטגרציה מתחילה באופן מיידי מרגע הכנסת השתל לאתר
- זמני השיקום קצרים מאוד
allowfullscreen="allowfullscreen">בעצם חזקה וטובה בעצם רכה או אם היתה אוגמנטציה בלסת תחתונה (מנדיבולה) 4 שבועות כ- 8 שבועות בלסת עליונה (מקסילה) 8 שבועות כ - 12 שבועות
- מומלץ במיוחד לקבוצות בסיכון כגון : מעשנים כבדים, סכרתיים, חולי אוסטאופרוזיס וחולים שעברו הקרנות
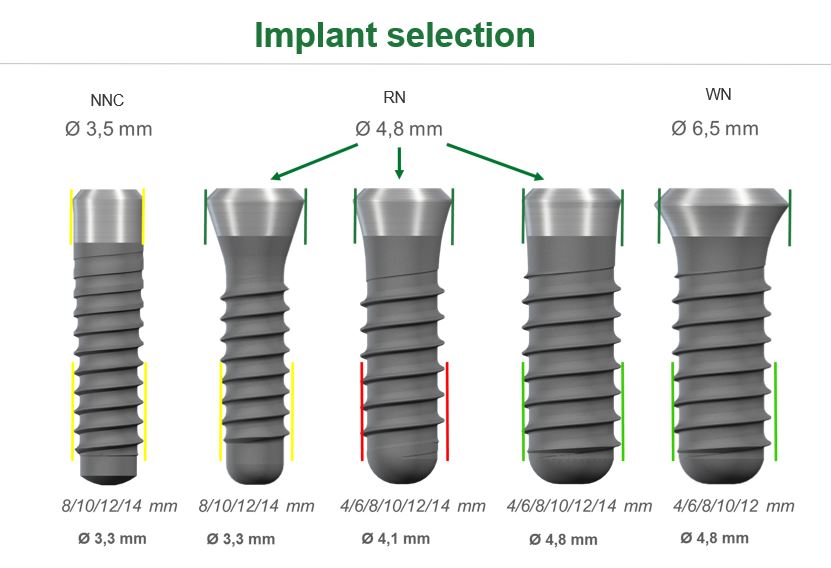
ניתן להשיג באורכים ב- 4,6,8,10,12,14,16 מ"מ
וובינרים בנושא שתלי Straumann
REFERENCES
1 Straumann SLActive implants compared to Straumann SLA implants. Lang NP, Salvi GE, Huynh-Ba G, Ivanovski S, Donos N, Bosshardt DD. Early osseointegration to hydrophilic and hydrophobic implant surfaces in humans. Clin Oral Implants Res. 2011 Apr;22(4):349-56. doi: 10.1111/j.1600-0501.2011.02172.x; Rupp F, Scheideler L, Olshanska N, de Wild M, Wieland M, Geis-Gerstorfer J. Enhancing surface free energy and hydrophilicity through chemical modification of microstructured titanium implant surfaces. Journal of Biomedical Materials Research A, 76(2):323-334, 2006. ; De Wild M. Superhydrophilic SLActive® implants. Straumann document 151.52, 2005 ; Katharina Maniura. Laboratory for Materials – Biology Interactions Empa, St. Gallen, Switzerland Protein and blood adsorption on Ti and TiZr implants as a model for osseointegration. EAO 22nd Annual Scientific Meeting, October 17 – 19 2013, Dublin ; Schwarz, F., et al., Bone regeneration in dehiscence-type defects at non-submerged and submerged chemically modified (SLActive®) and conventional SLA® titanium implants: an immunohistochemical study in dogs. J Clin.Periodontol. 35.1 (2008): 64–75. ; Rausch-fan X, Qu Z, Wieland M, Matejka M, Schedle A. Differentiation and cytokine synthesis of human alveolar osteoblasts compared to osteoblast-like cells (MG63) in response to titanium surfaces. Dental Materials 2008 Jan;24(1):102-10. Epub 2007 Apr 27. ; Schwarz F, Herten M, Sager M, Wieland M, Dard M, Becker J. Histological and immunohistochemical analysis of initial and early osseous integration at chemically modified and conventional SLA® titanium implants: Preliminary results of a pilot study in dogs. Clinical Oral Implants Research, 11(4): 481-488, 2007. Raghavendra S, Wood MC, Taylor TD. Int. J. Oral Maxillofac. Implants. 2005 May–Jun;20(3):425–31. 9 Oates TW, Valderrama P, Bischof M, Nedir R, Jones A, Simpson J, Toutenburg H, Cochran DL. Enhanced implant stability with a chemically modified SLA® surface: a randomized pilot study. Int. J. Oral Maxillofac. Implants. 2007;22(5):755–760.2 Nicolau P, Guerra F, Reis R, Krafft T, Benz K, Jackowski J. 10-year outcomes with immediate and early loaded implants with a chemically modified SLA surface. Quintessence Int. 2018 Dec 18:2-12.3 Patients treated with dental implants after surgery and radio-chemotherapy of oral cancer. Heberer S, Kilic S, Hossamo J, Raguse J-D, Nelson K. Rehabilitation of irradiated patients with modified and conventional sandblasted, acid-etched implants: preliminary results of a split-mouth study. Clin. Oral Impl. Res. 22, 2011; 546–551.4 Yerit, K., Posch, M., Seemann, M., Hainich, S., Dortbudak, O., Turhani, D., Ozyuvaci, H., Watzinger, R. and Ewers, R. (2006) Implant Survival in Mandibles of Irradiated Oral Cancer Patients. Clinical Oral Implants Research, 17, 337-344. http://dx.doi.org/10.1111/j.1600-0501.2005.01160.x.5 Verdonck, H.W.D., Meijer, G.J., Laurin, T., Nieman, F.H.M., Stoll, C., Riediger, D., Stoelinga, P.J.W. and de Baat, C. (2007) Assessment of Vascularity in Irradiated and Non-Irradiated Maxillary and Mandibular Alveolar Minipig Bone Using Laser Doppler Flowmetry. International Journal of Oral Maxillofacial Implants, 22, 774-778.6 Hu, W.W., Ward, B.B., Wang, Z. and Krebsbach, P.H. (2010) Bone Regeneration in Defects Compromised by Radiotherapy. Journal of Dental Research, 89, 77-81. http://dx.doi.org/10.1177/0022034509352151.7 Wang, R., Pillai, K. and Jones, P.K. (1998) Dosimetric Measurements of Scatter Radiation from Dental Implants in Stimulated Head and Neck Radiotherapy. International Journal of Oral Maxillofacial Implants, 13, 197-203.8 Grotz, K.A., Al-Nawas, B., Piepkorn, B., Reichert, T.E., Duschner, H. and Wagner, W.(1999) Micromorphological Findings in Jaw Bone after Radiotherapy. Mund-, Kiefer- und Gesichtschirurgie, 3, 140-145.9 Chambrone L, Mandia J, Shibli JA, Romito GA, Abrahao M. Dental Implants Installed in Irradiated Jaws: A Systematic Review. Journal of Dental Research. 2013;92(12 Suppl):119S-130S. doi:10.1177/0022034513504947.10 Shugaa-Addin B, Al-Shamiri H-M, Al-Maweri S, Tarakji B. The effect of radiotherapy on survival of dental implants in head and neck cancer patients. Journal of Clinical and Experimental Dentistry. 2016;8(2):e194-e200. doi:10.4317/jced.52346.11 Nooh N. Dental implant survival in irradiated oral cancer patients: a systematic review of the literature. Int J Oral Maxillofac Implants. 2013 Sep-Oct;28(5):1233-42. doi: 0.11607/jomi.3045.12 Dholam KP, Gurav SV. Dental implants in irradiated jaws: A literature review. J Can Res Ther [serial online] 2012 [cited 2016 Aug 17];8:85-93. Available from: http://www.cancerjournal.net/text.asp?2012/8/6/85/92220.13 Nelson, K., Stricker, A., Raguse, J.-D. and Nahles, S. (2016), Rehabilitation of irradiated patients with chemically modified and conventional SLA implants: a clinical clarification. J Oral Rehabil, 43: 871–872. doi:10.1111/joor.1243414 C. NACK, J.-D. RAGUSE, A. STRICKER , K. NELSON & S. NAHLES. Rehabilitation of irradiated patients with chemically modified and conventional SLA implants: five-year follow-up. Journal of Oral Rehabilitation 2015 42; 57—64.15 Devlin H, Garland H, Sloan P. Healing of tooth extraction sockets in experimental diabetes mellitus. J. of Oral Maxillofac. Surg. 1996; 54:1087-109116 Wang F1, Song YL, Li DH, Li CX, Wang Y, Zhang N, Wang BG. Type 2 diabetes mellitus impairs bone healing of dental implants in GK rats. Diabetes Res Clin Pract. 2010; 88:e7-9.17 IDF Diabetes Atlas, 7th Edition, 2015 http://www.diabetesatlas.org/.18 US Centers for Disease Control and Prevention. Diabetes 2014 report card. Available from: www.cdc.gov/diabetes/library/reports/congress.html. Accessed September 2015.19 El Chaar E, Zhang L, Zhou Y, Sandgren R, Fricain JC, Dard M, Pippenger B, Catros S. Osseointegration of Superhydrophilic Implants Placed in Defect Grafted Bones. Int J Oral Maxillofac Implants. 2019 March/April;34(2):443–450.20 Hotchkiss KM, Ayad NB, Hyzy SL, Boyan BD, Olivares-Navarrete R. Dental implant surface chemistry and energy alter macrophage activation in vitro. Clin. Oral Impl. Res. 00, 2016, 1–10. doi: 10.1111/clr.12814.21 Lee R, Hamlet SM, Ivanovski S. The influence of titanium surface characteristics on macrophage phenotype polarization during osseous healing in type I diabetic rats: A pilot study. Clin Oral Impl Res (accepted 4/8/2016).22 Straumann (2016). SLActive supports enhanced bone formation in a minipig surgical GBR model with coronal circumferential defects. Unpublished data.23 Müller E, Rottmar M, Guimond S, Tobler U, Stephan M, Berner S, Maniura K The interplay of surface chemistry and (nano-)topography defines the osseointegrative potential of Roxolid® dental implant surfaces. eCM Meeting Abstracts 2017, ollection 3; SSB+RM (page 31).24 EMPA (2017) Report additional experiments: Impact of RXD SLA, RXD SLAnano, RXD SLActive, and RXD pmod SLA surfaces on protein adsorption, blood coagulation, and osteogenic differentiation of HBCs. Final report: Impact of RXD SLA, RXD SLAnano, RXD SLActive, and RXD pmod SLA surfaces on protein adsorption, blood coagulation, and osteogenic differentiation of HBCs. EMPA, Swiss Federal Laboratories for Materials Science and Technology (data on file).25 Strauamnn (2017) Developed area ratio by nanostructures on Rxd modMA surface. Report SR0748. Unpublished data.26 Wennerberg A, Albrektsson T. On implant surfaces: a review of current knowledge and opinions. Int J Oral maxillofac Implants 2009: 24:63-7427 Kopf BS, Ruch S, Berner S, Spencer ND, Maniura-Weber K. 2015. The role of nanostructures and hydrophilicity in osseointegration: In-vitro protein-adsorption and blood-interaction studies. J Biomed Mater Res Part A2015:103A:2661–2672.28 Wennerberg A, Jimbo R, Stübinger S, Obrecht M, Dard M, Berner S. Nanostructures and hydrophilicity influence osseointegration – A biomechanical study in the rabbit tibia. Clin. Oral Impl. Res. 25, 2014, 1041–1050doi: 10.1111/clr.1221329 Chrcanovic BR, Albrektsson T, Wennerberg A Smoking and dental implants: A systematic review and meta-analysis. J Dent. 2015 May;43(5):487-9830 ChenY, Man Y Clinical evaluation of SLActive Titaniumzirconium narrow diameter implants for anterior and posterior crowns in smokers and nonsmokers group. Presented at the ITI World Symposium, Basel, May4-6, 2017 Abstract booklet: Clinical Research 045, p18.31 Hotchkiss KM et al. Novel in vitro comparative model of osteogenic and inflammatory cell response to dental implants. Dent Mater. 2019 Jan;35(1):176-184.32 Hsu JT, Shen YW, Kuo CW, Wang RT, Fuh LJ, Huang HL. Impacts of 3D bone-to- implant contact and implant diameter on primary stability of dental implant. J Formos Med Assoc. 2017 Aug;116(8):582-590. ; Buser D, Schenk RK, Steinemann S, Fiorellini JP, Fox CH, Stich H. Influence of surface characteristics on bone integration of titanium implants. A histomorphometric study in miniature pigs. J Biomed Mater Res. 1991 Jul;25(7):889-902 ; Smeets R, Stadlinger B, Schwarz F, Beck-Broichsitter B, Jung O, Precht C, Kloss F, Gröbe A, Heiland M, Ebker T. Impact of Dental Implant Surface Modifications on Osseointegration. Biomed Res Int. 2016;2016:6285620. ; Goyal N., Priyanka R. K. Effect of various implant surface treatments on osseointegration – a literature review. Indian Journal of Dental Sciences. 2012;4:154–157




























